寄生虫特异性CD4+ Th1细胞反应是控制疟疾感染的主要免疫效应者;然而,其潜在的调节机制仍然大部分未知。
2024年2月23日,陆军军医大学徐文岳和刘太平共同通讯在Autophagy 在线发表题为“ATG5-regulated CCL2/MCP-1 production in myeloid cells selectively modulates anti-malarial CD4+ Th1 responses”的研究论文,该研究表明在髓样细胞中的ATG5缺乏可以通过选择性增强寄生虫特异性CD4+ Th1细胞反应显著抑制啮齿类血液期疟疾寄生虫的生长。这种效应与ATG5介导的经典和非经典自噬无关。从机制上讲,ATG5缺乏抑制了LY6G− ITGAM/CD11b+ ADGRE1/F4/80−细胞的FAS介导的凋亡,随后增加了感染寄生虫的小鼠中CCL2/MCP-1的产生。
LY6G− ITGAM+ ADGRE1−细胞源性CCL2通过JAK2-STAT4途径选择性地与CD4+ Th1细胞的CCR2相互作用,以优化它们的反应。重组CCL2的给予显著促进了寄生虫特异性CD4+ Th1细胞反应,并抑制了疟疾感染。总的来说,该研究突显了ATG5在调节髓样细胞凋亡方面的之前未被认识的作用,进而影响了CCL2的产生,从而选择性地促进了CD4+ Th1细胞反应。该研究为免疫干预和有效的抗疟疾疫苗的开发提供了新的见解。

寄生虫特异性CD4+ T细胞是宿主对抗疟疾血液阶段的主要免疫保护效应者。疟疾血液阶段感染诱导CD4+ T细胞分化为T辅助(Th)1和滤泡辅助(Tfh)细胞。Tfh细胞支持B细胞亲和力成熟并产生疟疾寄生虫特异性免疫球蛋白G(IgG),而CD4+ Th1细胞通过IFNG/IFN-γ分泌增强巨噬细胞杀灭被捕获寄生虫。目前,大多数疟疾血液阶段疫苗旨在诱导抗体对抗裂殖子表面抗原,以防止其入侵红细胞。然而,免疫选择过程中表面抗原的广泛多态性阻碍了有效的疟疾血液阶段疫苗的开发。相反,被CD4+ Th1细胞识别的表位是线性的,并且存在于疟疾寄生虫的内部抗原中。由衰减的血液阶段疫苗诱导的寄生虫特异性CD4+ Th1反应可以赋予对同源或异源菌株的挑战的高度保护性免疫力。因此,了解抗疟疾CD4+ Th1反应的知识可以为设计免疫干预和有效的疟疾血液阶段疫苗提供新的见解。
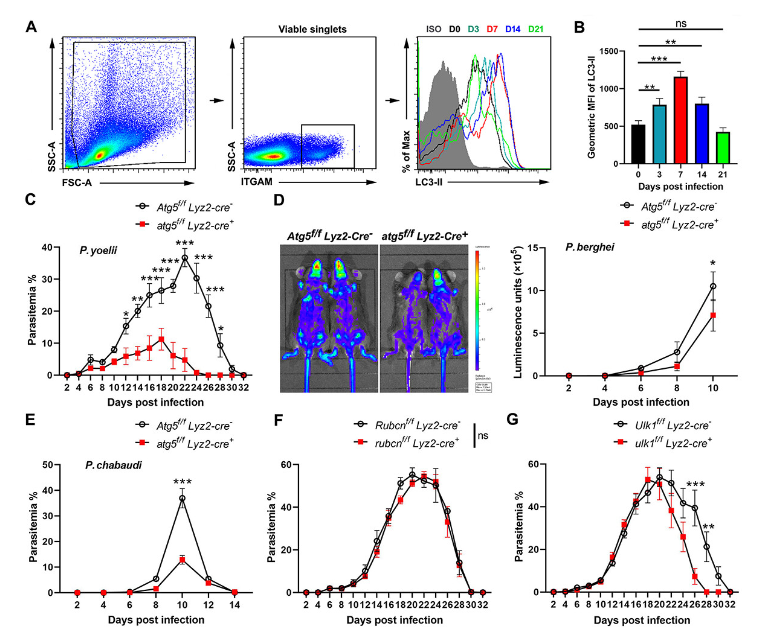
在独立自噬的atg5f/f Lyz2-Cre+小鼠中,疟疾血期的生长受到显著抑制(图片源自Autophagy )
在脾脏中,CD4+ T细胞通过配位抗原载荷的树突状细胞(DCs)被激活。它们在感染疟疾寄生虫7天后分化为Th1和Tfh细胞。众所周知,Th1的分化由CD4+ T细胞的分化指定转录因子TBX21/T-bet引导,CD4+ T细胞的细胞内感知外源性ATP也驱动疟原虫特异性Th1分化。即使Th1分化已经建立,Th1反应的幅度也受共刺激分子(包括ICOS、PDCD1LG2/PD-L2和TNFRSF4/OX40)以及细胞因子(如类型I IFN、IL10和IL27)的调节。有趣的是,Th细胞表达一组特定的趋化因子受体,最近提出趋化因子介导的DC与CD4+ T细胞之间的相互作用来调节Th1分化。在疟疾中,CXCL9和CXCL10表达的炎性单核细胞的耗竭会减少Th1分化;然而,它们对Th1反应的调节效应是矛盾的。
经典自噬是一种胞内大量降解过程,可以清除不需要的细胞质成分。LC3也可以被招募到吞噬体膜上,这一过程称为非经典自噬或LC3相关吞噬(LAP),以促进吞噬体成熟和载体降解。值得注意的是,报道了在肿瘤浸润的髓样细胞(LY6G− ITGAM/CD11b+ LY6Chi)中诱导了经典和非经典自噬以抑制抗肿瘤CD4+ T细胞反应。在疟疾中,骨髓产生的炎性单核细胞被招募到脾脏中,以部分补充被感染导致减少的驻地巨噬细胞并吞噬寄生虫感染的红细胞。因此,该研究检测了自噬和LAP是否也在髓样细胞中诱导,并探讨了它们在调节疟疾感染期间CD4+ T细胞反应中的作用。
该研究观察到ATG5的缺乏,与自噬无关,导致LY6G− ITGAM + ADGRE1/F4/80−细胞的存活,进而增加了CCL2/MCP-1的产生,这有选择地促进了抗疟疾CD4+ Th1反应。在机制上,LY6G− ITGAM+ ADGRE1−细胞分泌的趋化因子CCL2与CD4+ Th1细胞上的CCR2相互作用促进了它们的优化反应,这依赖于JAK2-STAT4途径。引人注目的是,CCL2的给予显著促进了寄生虫特异性CD4+ Th1反应并抑制了寄生虫的生长。
原文链接:https://doi.org/10.1080/15548627.2024.2319512













